REGANGAN RUANG
Regangan Ruang dalam Struktur Molekul Organik

Sikloalkana (disebut juga naftena - jangan terbalik dengan
naftalena) adalah sebuah tipe alkana yang mempunyai satu atau lebih cincin atom
karbon pada struktur kimia molekulnya. Sikloalkana
merupakan golongan senyawa hidrokarbon jenuh yang rantai atom-atom
karbon-karbonnya tertutup (membentuk cincin), sehingga termasuk hidrokarbon
siklik.
Sikloalkana
ialah alkana yang disusun dalam gelang yang mempunyai formula CnH2n.
Sikloalkana dinamakan dengan menambahkan awalan siklo kepada nama alkana
yang menunjukkan bilang atom karbon dalam gelang. Biasanya, sikloalkana
ditulis dengan menggunakan struktur garis ikatan.
Sikloalkana
dengan jumlah atom karbon lebih dari tiga akan membentuk
lipatan/lekukan,sehingga tidak membentuk bidang datar. Meskipun lekukan
menjadikan ikatan salah satu sudut C-C-C lebih kecil daripada bila
membentuk bidang datar, namun dengan lekukan maka atom-atomhidrogen menjadi
kurang
eclipse, sehingga tegangan dan
tolakan antar atom membentuk struktur yang paling stabil. Terjadinya
lekukan cincin lingkar dengan enam karbon menghasilkan konformasi kursi.
Dengan bentuk kursi, sudut ikatan C-C menjadi sama dengan sudut ikatan
tetrahedral dan posisi atom hidrogen yang terikat pada atom karbon di
sebelahnya staggered, sehingga tolakan antara atom H menjadi minimum.
Pasangan-pasangan
elektron yang saling berdekatan, mengakibatkan terjadinya tolak menolak antara
pasangan-pasangan elektron yang menghubungkan atom-atom karbon. Ini membuat
ikatan-ikatan lebih mudah terputus.
Sifat
kimia sikloalkana merupakan pengembangan konsep atau materi pengayaan.
Penalarannya tidak sulit dan sifatnya mirip alkana.
Sikloalkana, sifatnya mirip dengan alkana, yaitu rantai atom C memiliki ikatan kovalen tunggal . Akibat dari reaksinya mengalami subtitusi
Sikloalkana, sifatnya mirip dengan alkana, yaitu rantai atom C memiliki ikatan kovalen tunggal . Akibat dari reaksinya mengalami subtitusi
Perbedaan
alkana dan sikloalkana adalah Alkana tergolong alifatis, yaitu rantainya
terbuka, sedang sikloalkana adalah hidrokarbon siklis, rantainya tertutup.
Rantai terbuka berarti gerakan molekulnya lebih leluasa. Sedangkan sikloalkana
seperti dipaksakan, kemungkinan besar sikloalkana lebih mudah bereaksi. Apalagi
siklopropana yang rantai C-nya terpendek. Jadi siklopropana paling tidak stabil
atau paling realtif."
Dalam teori regangan Baeyer, yang menyarankan bahwa cincin kecil dan besar mungkin tidak stabil karena adanya angle-strain yang terinduksi dalam molekul ketika sudut ikatan dipaksa untuk menyimpang dari nilai tetrahedral yang ideal 109°. Berdasarkan teori ini, gagasan geometris sederhana pada three-membered ring (cyclopropane) harus segitiga sama sisi dengan sudut ikatan dari 60° daripada 109°, four-membered ring (cyclobutane) harus menjadi persegi dengan sudut ikatan 90°, five-membered ring harus menjadi pentagon biasa dengan sudut ikatan 108°, dan seterusnya. Melanjutkan argumen ini, cincin besar akan meregang dengan memiliki sudut ikatan yang jauh lebih besar dari 109°.
(https://www.academia.edu/24631611/Tegangan_Cincin_Pada_Sikloalkana_dan_Siloalkena).
Senyawa siklik
adalah senyawa - senyawa karbon yang rantai C-nya berlingkar dan rantai lingkarannya itu memungkinkan mempunyai rantai cabang.Oleh
karena itu senyawa-senyawa siklik juga mepunyai bentuk konformasikarena senyawa siklik merupaan senyawa yang mempunyai atom
C-nya berlingkar.
(https://www.scribd.com/doc/45091495/makalah-Siklik).
Kestabilan
(ketidakreaktifan) sikloalkana pada mulanya dijelaskan dengan “teori regangan
Baeyer” (Baeyer’s strain theory). Menurut teori ini, senyawa siklik
seperti halnya sikloalkana membentuk cincin datar. Bila sudut-sudut ikatan
dalam senyawa siklik menyimpang dari sudut ikatan tetrahedral (109,50) maka molekulnya
mengalami regangan. Semakin besar penyimpangannya terhadap sudut ikatan
tetrahedral, molekulnya akan semakin regang, dan mengakibatkan molekul tersebut
akan semakin reaktif.
·
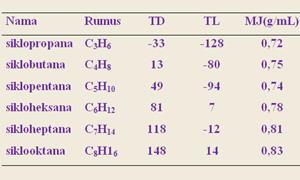
Siklopropana
: 499,83/3 = 166,61 kkal/mol
·
Siklobutana
: 655,86/4 = 163,96 kkal/mol
·
Siklopentana
: 793,52/5 = 158,71 kkal/mol
·
Sikloheksana
: 944,48/6 = 157,41 kkal/mol
Sikoalkana
memiliki kereaktifan yang sangat mirip dengan alkana, kecuali untuk sikloalkana
yang sangat kecil – khususnya siklopropana. Siklopropana jauh lebih reaktif
dibanding yang mungkin kita kira. Alasannya karena sudut-sudut ikatan
dalam cincin. Normalnya, apabila karbon membentuk empat ikatan tunggal, maka
sudut-sudut ikatannya adalah sekitar 109,5°. Pada siklopropana sudut ini
sebesar 60°.

Dalam usaha mengurangi regangan agar
diperoleh kestabilan, molekul sikloalkana mengalami konformasi. Pada
siklopentana konformasinya mengakibatkan keempat atom karbonnya berada dalam
satu bidang dan atom karbon kelima membentuk ikatan bengkok. Pada sikloheksana
konformasinya mengakibatkan semua ikatan C-C-C mempunyai sudut 109,50. Salah
satu dari konformasi pada sikloheksana dinamakan konformasi kursi, yang
ditandai oleh adanya dua macam orientasi ikatan C-H, yaitu enam buah ikatan C-H
aksial dan enam buah ikatan C-H ekuatorial. Dikenal pula adanya konformasi
perahu pada sikloheksana, yang kestabilannya lebih rendah daripada konformasi
kursi. Jika satu atom H pada sikloheksana diganti oleh gugus –CH3
Bila sikloalkana mengikat substituen pada
dua atau lebih atom karbon, maka terjadi isomer cis-trans. Salah satu contohnya
adalah pada 1,2-dimetilsiklopentana. Dalam penggambaran strukturnya, cincin
siklopentana digambarkan sebagai segilima datar, dengan ketentuan bila kedua
substituennya terletak pada sisi yang sama dari bidang cincin dinamakan isomer
cis, sedangkan bila berseberangan dengan bidang cincin dinamakan isomer trans.
(http://mychemicaldream.blogspt.co.id/2012/09/sikloalkana.html).
Terimakasih artikel ini bermanfaat untuk saya
BalasHapusTerima kasih kembali saudari Jihan telah mengunjungi blog saya. Semoga bermanfaat untuk kita semua:) semangat
HapusTerimakasih, apa saja faktor penyebab terjafinya regangan ruang mohon penjelasannya
BalasHapussaya ingin bertanya, apakah suhu dan tekanan berpengaruh terhadap regangan ruang..? jika iya, bagaimana peristiwa itu terjadi
BalasHapusTerima kasih telah mengunjungi blog saya serta pertanyaannya.
HapusMenurut saya iya, karena dengan adanya suhu dan tekanan yang tinggi terhadap suatu senyawa, dapat menyebabkan terjadinya regangan ruang dalam struktur molekul senyawa tersebut. Suhu dan tekanan tersebut menyebabkan terjadinya pemutusan ikatan dalam molekul, dengan putusnya salah satu ikatan tersebut menyebabkan struktur molekul tidak stabil dan mengalami regangan ruang dengan perubahan struktur untuk mencapai suatu kestabilan.
Semoga membantu:)
Trimakasih yaaa
BalasHapusTerima kasih kembali saudari Amino karena telah mengunjungi blog saya:) semoga bermanfaat.
HapusTerima kasih atas penjelasaanya sangat bermanfaat
BalasHapusAlhamdulillah..
HapusTerima kasih saudari Liza atas kunjungannya ke blog saya. Semoga bermanfaat ya:)
Terima kasih, materinya dapat dijadikan referensi
BalasHapus