Struktur Molekul Senyawa Organik
Senyawa organik adalah golongan besar
senyawa kimia yang molekulnya mengandung karbon, kecuali karbida, karbonat, dan
oksida karbon. Studi mengenai senyawaan organik disebut kimia organik. Banyak
di antara senyawaan organik, seperti protein, lemak, dan karbohidrat, merupakan
komponen penting dalam biokimia.
Di antara beberapa golongan senyawaan
organik adalah senyawa alifatik, rantai karbon yang dapat diubah gugus
fungsinya; hidrokarbon aromatik, senyawaan yang mengandung paling tidak satu
cincin benzena; senyawa heterosiklik yang mencakup atom-atom nonkarbon dalam
struktur cincinnya; dan polimer, molekul rantai panjang gugus berulang.
RESONANSI
Resonansi secara
singkat dapat dikatakan dengan suatu senyawa kimia yang strukturnya sama tetapi
konfigurasi elektronnya berbeda. Resonansi: pergeseran
pasangan elektron p terkonyugasi dengan
pasangan elektron p yang lain, pasangan elektron bebas, atau orbital kosong.
Asam asetat (pKa 4,8) seratus ribu juta (1011)kali lebih asam dibandingkan etanol (pKa =18). Mengapa? karena muatan negatif dari atom oksigen pada ion asetat mampu disebarkan (didelokalisasi) pada gugus karbonil melalui resonansi sedangkan pada ion etoksida muatan negatifnya hanya ditanggung (dilokalisasi) pada atom oksigen saja
(http://ratnaningsih.staf.upi.edu/2011/09/17/download-kimia-organik-fisik/)
(http://ratnaningsih.staf.upi.edu/2011/09/17/download-kimia-organik-fisik/)
HIPERKONJUGASI
Jenis delokalisasi ketiga adalah yang
melibatkan elektron σ, dan disebut hiperkonjugasi. Jika suatu karbon yang
mengikat atom hidrogen dan terikat pada atom tak jenuh atau pada satu atom yang
mempunyai orbital bukan ikatan
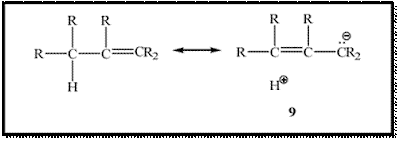
Di dalam bentuk
kanonik seperti itu sama sekali tidak ada ikatan antara karbon dengan hidrogen,
dan resonansi seperti itu disebut resonansi tanpa ikatan. Hidrogen tidak pergi
(karena resonansi tersebut bukanlah suatu hal yang nyata melainkan hanya bentuk
kanonik yang berkontribusi ke struktur molekul nyata). Efek struktur 9 pada
molekul nyata adalah elektron dalam C-H lebih dekat ke karbon daripada jika
struktur 9 tidak berkontribusi.
Hiperkonjugasi di
atas dapat dipandang sebagai overlap antara orbital σ ikatan CH dengan orbital
π ikatan C=C, analog dengan overlap π-π. Konsep hiperkonjugasi muncul dari
penemuan penyimpangan pola pengusiran elektron gugus alkil. Dengan efek medan
sendiri, urutan kemampuan mengusir elektron untuk alkil sederhana yang terikat
pada sistem tak jenuh adalah t-butil > isobutil > etil > metil.
Kemudian, moment dipole dalam fase gas PhCH3, PhC2H5, PhCH(CH3)2, dan PhC(CH3)3
berturut-berturut adalah 0,37; 0,58; 065; dan 0,70 D.
Ada fakta yang menunjukkan bahwa hiperkonjugasi adalah penting bagi
karbokation, radikal bebas, dan molekul keadaan tereksitasi. Hiperkonjugasi molekul
netral dalam keadaan dasar (Muller dan Mullikan menyebut hiperkonjugasi
pengorbanan), bentuk kanonik tidak hanya melibatkan resonansi tanpa ikatan tapi juga
pemisahan muatan yang tidak dimiliki oleh bentuk utama. Di dalam radikal dan
karbokation, bentuk kanonik tidak lagi memperlihatkan adanya pemisahan muatan.
Muller dan Mullikan menyebut hiperkonjugasi isovalen. Bahkan di sini bentuk utama
lebih berkontribusi ke hibrida resonansi daripada bentuk yang lain
EFEK
INDUKSI
Asam
metanoat lebih asam dari asam etanoat karena
pada asam etanoat terdapat gugus metil yang mempunyai kemampuan
mendorong elektron ikatan melalui ikatan sigma
(C-C-O-H) sehingga atom O menjadi relatif makin negatif, akibatnya atom
H sukar lepas sebagai H+, asamnya menjadi lebih lemah.
Gugus CH3 mempunyai efek induksi mendorong elektron,
diberi simbol +I.
Asam
alfamonoflouroetanoat lebih asam dari asam metanoat karena pada asam alfa monoflouroetanooat terdapat gugus F
yang mempunyai kemampuan menarik elektron ikatan melalui ikatan sigma sehingga
atom O menjadi relatif makin positif, akibatnya atom H makin mudah lepas
sebagai H+, asamnya menjadi lebih kuat. Gugus
F mempunyai efek induksi menarik elektron diberi simbol -I
Efek
induksi bekerja melalui ruang dan ikatan sigma. Makin jauh letak gugus/atom
yang memiliki efek induksi, makin kecil pengaruhnya terhadap polarisai ikatan (http://ratnaningsih.staf.upi.edu/2011/09/17/download-kimia-organik-fisik/).
TAUTOMERI
Bagi
kebanyakan senyawa, semua molekul mempunyai struktur yang sama, apakah struktur
tersebut dapat memuaskan atau tidak dinyatakan dengan struktur Lewis. Tetapi
ada juga senyawa lain yang ada dalam satu campuran dari dua atau lebih senyawa
yang secara struktural berbeda, dan campuran berada dalam kesetimbangan yang
cepat. Jika fenomena ini (disebut tautomeri) ada maka ada pergeseran
bolak-balik yang cepat antara molekul-molekul yang kesetimbangan tersebut. Di
dalam peristiwa ini ada proton yang berpindah dari satu atom dalam satu molekul
ke atom yang lain menjadi molekul lain (https://wanibesak.files.wordpress.com/2011/06/kimia-organik-fisis-i.pdf).
VAN DER WAALS
Gaya Van Der Waals terjadi
akibat interaksi antara molekul-molekul non polar (Gaya London), antara
molekul-molekul polar (Gaya dipole-dipol) atau antara molekul non polar dengan
molekul polar (Gaya dipole-dipol terinduksi). Ikatan Van Der Waals terdapat
antar molekul zat cair atau padat dan sangat lemah.
Gaya Van Der Waals dahulu
digunakan untuk menunjukkan semua jenis gaya tarik-menarik antar molekul. Namun
kini merujuk pada pada gaya-gaya yang timbul dari polarisasi molekul yang
terlemah menjadi dipole seketika. Pada saat tertentu, moleku-molekul dapat
berada dalam fase dipole seketika ketika salah satu muatan negative berada di
sisi tertentu. Dalam keadaan dipol ini, molekul dapat menarik atau menolak electron
lain dan menyebabkan atom lain menjadi dipole. Gaya tarik menarik yang muncul
sesaat ini merupakan gaya Van Der Waals
Klasifikasi Gaya Van der Waals
Gaya Van Der Walls dapat dibagi berdasarkan jenis kepolaran molekulnya, yaitu :
1.
Interaksi ion–dipole
Gaya antarmolekul ini terjadi antara ion dan
senyawa kovalen polar. Ketika dilarutkan dalam senyawa kovalen polar, senyawa
ion akan terionisasi menjadi ion positif dan ion negatif. Ion positif akan
tarik menarik dengan dipol negatif, dan sebaliknya.
Selain gaya ion-dipol, juga dikenal gaya
ion-dipol sesaat, dimana terjadi dari interaksi antar gaya dipol-dipol
terinduksi dengan gaya ion-dipol. Jika ion dari senyawa ion berdekatan dengan
molekul nonpolar, ion tersebut dapat menginduksi dipol molekul nonpolar. Dipol
terinduksi molekul nonpolar yang dihasilkan akan berikatan dengan ion.
Gaya Ion-dipol
Interaksi ion - dipol merupakan interaksi (berikatan)/ tarik menarik antara
ion dengan molekul polar (dipol). Interaksi ini termasuk jenis interaksi yang relatif cukup
kuat.
Contoh :
H+ + H2O → H3O+
Ag+ +
NH3 → Ag(NH3)+
Sebagai contoh, NaCl (senyawa ion) dapat larut dalam air
(pelarut polar) dan AgBr
(senyawa ion) dapat larut dalam NH3 (pelarut polar).
2.
Interaksi dipol-dipol
Interaksi dipol-dipol merupakan interaksi antara sesama molekul polar (dipol).
Interaksi ini terjadi antara ekor dan kepala dimana jika
berlawanan kutub maka akan tarik-menarik dan sebaliknya.
Tanda "+" menunjukkan dipol
positif, tanda "-" menunjukkan dipol negatif
Molekul seperti HCl memiliki dipol permanen
karena klor lebih elektronegatif dibandingkan hidrogen. Kondisi permanen ini,
pada saat pembentukan dipol akan menyebabkan molekul saling tarik menarik satu
sama lain. Molekul yang memiliki dipol permanen akan memiliki titik didih yang
lebih tinggi dibandingkan dengan molekul yang hanya memiliki dipol yang
berubah-ubah secara sementara.
3.
Interaksi ion - dipol terinduksi
Interaksi ion-dipol terinduksi merupakan interaksi antara aksi ion dengan dipol terinduksi. Dipol terinduksi
merupakan molekul
netral yang menjadi dipol akibat induksi partikel bermuatan yang
berada didekatnya.Partikel
penginduksi tersebut dapat berupa ion atau dipol lain dimana
kemampuan menginduksi ion lebih besar daripada kemampuan menginduksi dipol karena muatan ion yang juga
jauh lebih besar. Interaksi ini relatif lemah karena kepolaran molekul terinduksi relatif
kecil daripada dipol
permanen.
Contoh : I- + I2 → I3
4.
Interaksi dipol - dipol terinduksi
Suatu molekul polar yang berdekatan dengan
molekul nonpolar, akan dapat menginduksi molekul nonpolar. Akibatnya. Molekul
nonpolar memiliki dipol terinduksi.
Dipol dari molekul polar akan saling
tarik-menarik dengan dipol terinduksi dari molekul nonpolar. Contohnya terjadi
pada interaksi antara HCl (molekul polar) dengan Cl2 (molekul
nonpolar).
5.
Interaksi dipol terinduksi - dipol
terinduksi
Mekanisme terjadinya
interaksi dipol terinduksi - dipol terinduksi :
Pasangan elektron suatu molekul, baik yang
bebas maupun yang terikat selalu bergerak mengelilingi inti elektron yang bergerak dapat mengimbas atau
menginduksi sesaat pada tetangga sehingga molekul tetangga menjadi polar
terinduksi sesaat molekul
ini pula dapat menginduksi molekul tetangga lainnya sehingga terbentuk molekul-molekul dipol sesaat.
GUGUS FUNGSI
Gugus fungsi mengacu pada
atom tertentu yang terikat dalam susunan tertentu yang memberikan sifat fisik
dan kimia tertentu senyawa. Gugus fungsi adalah Sekelompok atom yang
bertanggung jawab untuk reaksi karakteristik senyawa.
Gugus fungsi adalah kelompok
tertentu atom atau ikatan dalam senyawa yang bertanggung jawab untuk
karakteristik reaksi kimia senyawa itu. Gugus fungsi yang sama akan berperilaku
dengan cara yang sama (misalnya, mengalami reaksi yang sama) terlepas dari
senyawa yang menjadi bagiannya. Gugus fungsi juga memainkan peranan penting
dalam nomenklatur senyawa organik; menggabungkan nama-nama kelompok fungsional
dengan nama-nama alkana induk menyediakan cara untuk membedakan senyawa (http://ilmualam.net/pengertian-gugus-fungsi.html).
REGANGAN RUANG
Dalam teori regangan Baeyer, yang
menyarankan bahwa cincin kecil dan besar mungkin tidak stabil karena adanya
angle-strain yang terinduksi dalam molekul ketika sudut ikatan dipaksa untuk
menyimpang dari nilai tetrahedral yang ideal 109°. Berdasarkan teori ini,
gagasan geometris sederhana pada three-membered ring (cyclopropane) harus
segitiga sama sisi dengan sudut ikatan dari 60° daripada 109°,
four-membered ring (cyclobutane) harus menjadi persegi dengan sudut ikatan 90°,
five-membered ring harus menjadi pentagon biasa dengan sudut ikatan 108°, dan
seterusnya. Melanjutkan argumen ini, cincin besar akan meregang dengan memiliki
sudut ikatan yang jauh lebih besar dari 109°.
(https://www.academia.edu/24631611/Tegangan_Cincin_Pada_Sikloalkana_dan_Siloalkena).
IKATAN HIDROGEN
Ikatan hidrogen adalah ikatan lemah yang
terbentuk diantara atom hidrogen bermuatan positif dalam satu molekul yang
terikat secara kovalen dengan molekul lain yang terikat secara kovalen tetapi
bermuatan negatif. Sebagai contoh, air membentuk ikatan hidrogen diantara
molekul-molekul air.
Karena atom-atom
dalam air membentuk ikatan kovalen polar, daerah positif pada H2O
disekeliling proton hidrogen menarik daerah negatif pada molekul H2O
yang bersebelahan. Tarik menarik ini membentuk ikatan hidrogen. Air juga
merupakan pelarut yang baik untuk senyawa ionik dan banyak lainnya karena mudah
membentuk ikatan hidrogen dengan zat terlarut.
Ikatan hidrogen
adalah interaksi yang melibatkan atom hidrogen yang terletak antara sepasang
atom lain yang memiliki afinitas elektron tinggi. Ikatan tersebut lebih lemah
dari ikatan kovalen atau ikatan ion, tetapi lebih kuat dari gaya van der Waals.
Ikatan hidrogen dapat terjadi antara atom-atom dalam molekul yang berbeda atau
dalam bagian-bagian dari molekul yang sama. Satu atom dari pasangan (donor),
umumnya fluor, nitrogen, atau atom oksigen, secara kovalen terikat pada atom
hidrogen (-FH, -NH, atau -OH), dengan berbagi elektron secara tidak merata;
Afinitas electron yang tinggi menyebabkan hidrogen untuk mengambil muatan yang
sedikit lebih positif. Atom lain dari pasangan, F, N, atau O, juga biasanya
memiliki pasangan elektron yang tidak dibagi, yang memberikan muatan sedikit
lebih negatif (http://www.g-excess.com/pengertian-ikatan-hidrogen.html).
POLARIZABILITAS
Mudah
tidaknya suatu molekul membentuk dipol sesaat disebut Polarisabilitas.
Hal ini berkaitan dengan massa molekul relatif (Mr) dan bentuk molekul.
Massa molekul relatif berkaitan dengan jumlah elektron dalam molekul maka makin
mudah mengalami polarisasi sehingga makin kuat gaya Londonnya.
Gaya Dipol Sesaat-Dipol
Terinduksi (Gaya dispersi London)
Gaya
London atau dispersi adalah terjadinya tarikan yang lemah disebabkan oleh dipol
imbasan sekejap atau dipol sesaat. Terjadinya gaya dispersi pada molekul
nonpolar akibat adanya pergerakan elektron mengelilingi inti secara acak,
sehingga pada suatu saat elektron-elektron tersebut akan mengumpul pada salah
satu sisi atom molekul.
Gaya
London adalah gaya tarik lemah yang disebabkan oleh adanya dipol imbasan
sesaat.
Terima Kasih,
Semoga Bermanfaat:)
trimkasih atas paparannya, sangat bermanfaat, boleh mintak penjelasan contohnya lebih banyak lgi tdk..??
BalasHapusTerima kasih kembali telah berkunjung ke blog saya. Baiklah nanti akan saya perbaiki dan tambahkan pada penjelasan masing-masing pokok bahasannya:)
HapusTerima kasih atas informasinya? Mohon dijelaskan bagaimana hubungan ikatan hidrogen dalam struktur molekul senyawa organik? Mohon di jawab ya
BalasHapusTerima kasih atas informasinya? Mohon dijelaskan bagaimana hubungan ikatan hidrogen dalam struktur molekul senyawa organik? Mohon di jawab ya
BalasHapusTerima kasih atas penjelasan yang telah anda paparkan. Namun saya masih kurang mengerti mengenai efek induksi. Bisa tolong anda berikan penjelasan dengan contohnya? Terima kasih
BalasHapusTerima kasih telah berkunjung ke blog saya serta atas pertanyaannya:)
HapusEfek induksi adalah tarikan kerapatan elektron melalui obligasi sigma (σ) disebabkan oleh perbedaan elektronegativitas dalam atom.
Efek induksi dari gugus yang terikat pada rantai R dari asam karboksilat (gugus COOH)
H2O
R – COOH+ + R - COO –
Bila ada gugus yang terkait pada alkil dari asam karboksilat bersifat menarik elektron, maka efek induktif akan diteruskan kesemua atom, oksigen dari hidroksida pada asam menjadi relatif lebih positif, hydrogen mudah lepas kesamaan karboksilat bertambah.
Semoga membantu:)
Terima kasih materinya sangat bermanfaat
BalasHapusALhamdulillah..
HapusTerima kasih atas kunjungan Anda pada blog saya, semoga bermanfaat:)
Materinya sangat bermanfaat. Terimakasihh
BalasHapusALhamdulillah..
HapusTerima kasih atas kunjungan Anda pada blog saya, semoga bermanfaat:)